 大阪大学最先端医療イノベーションセンターの共同研究講座での研究風景(塩野義製薬提供)
大阪大学最先端医療イノベーションセンターの共同研究講座での研究風景(塩野義製薬提供)
今年のノーベル生理学・医学賞の受賞が決まった大阪大の坂口志文・特任教授らが発見した制御性T細胞(Treg)。このTregに関連した固形がん治療薬「s-531011」を塩野義製薬が開発中だ。しかも低分子と呼ばれる分子量の少ない化合物で強みを見せてきた塩野義では珍しい高分子(抗体医薬)だ。連載『製薬フロンティア』の本稿では、この新薬における開発と薬理研究の両責任者に画期性や患者メリットを語ってもらった。(ダイヤモンド編集部 土本匡孝)
坂口氏のノーベル賞受賞で注目集まる
塩野義製薬が開発中のがん治療薬
今年のノーベル生理学・医学賞に、大阪大学免疫学フロンティア研究センター特任教授の坂口志文氏ら3人が選ばれた。
坂口氏らが発見した制御性T細胞(Treg)は人間の体内にあって、過剰な免疫反応を抑える調整・ブレーキ役として機能するもの。このTregを増やしたり除去したりすることで病気を治す新薬を創ろうと、世界の製薬会社で研究が進められている。
例えば中外製薬が大阪大学免疫学フロンティア研究センターと共同研究で、Tregで重要な役割を持つ「FoxP3(フォックス・ピー・スリー)」というタンパク質を制御する新たなしくみを発見し、自己免疫疾患を治療する可能性を見いだした。アステラス製薬も坂口氏らとの研究グループで、Tregを誘導し炎症を抑える化合物を発見している。
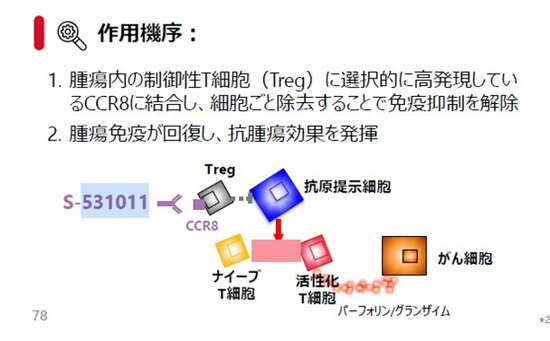
そうした中で、具体的な新薬の動きが見えているのは塩野義製薬だ。塩野義は2014年、大阪大学最先端医療イノベーションセンター内に共同研究講座を開設し、坂口氏の指導の下、腫瘍免疫およびTregに関する研究を行ってきた。その過程で、腫瘍に浸潤するTregに特異的に発現する分子CCR8を発見。このCCR8を標的とした抗体医薬「S-531101」の固形がん患者を対象とした臨床試験を22年に日米で始めた。
作用機序(薬が体内で効果を発揮するまでの一連の仕組み)は以下の通り。がんの中のTregを除去して免疫抑制を解除することで、体に備わっているがんへの免疫効果(攻撃)を高めるという建て付けだ。
 塩野義製薬のIR資料より 拡大画像表示
塩野義製薬のIR資料より 拡大画像表示
現在は臨床試験第1相(フェーズ1)と第2相(フェーズ2)を同時進行中だ。
坂口氏のノーベル賞受賞が決まった10月6日の翌週、ダイヤモンド編集部はこの新薬における開発と薬理研究を担う塩野義の両責任者にインタビューした。次ページでは、二人のキーマンに新薬の画期性と患者メリットについて語ってもらった。







